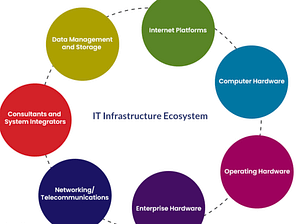
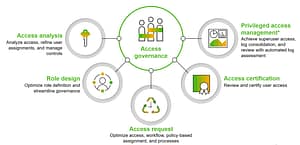
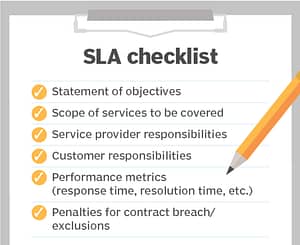
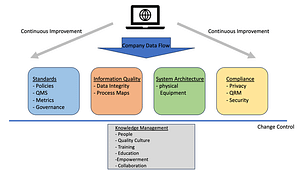
SAP S/4HANA ist die neue Version von SAP, die grundlegende Änderungen in der Datenverwaltung mit sich bringt. Im Rahmen eines technischen Updates sind umfangreiche technische Anpassungen und notwendige Tests erforderlich. Als Validation Manager eines Pharmaunternehmens, sichert QFINITY die Qualität beim Upgrade und gewährleistet einen reibungslosen Ablauf des gesamten Prozesses.
Um einen reibungslosen Übergang zu gewährleisten, plant und erarbeitet QFINITY sorgfältig die Aktualisierung, insbesondere der Validierungsdokumente. Hierbei kommt auch das smartShift Tool der SAP zum Einsatz, das eine teilautomatisierte Anpassung des Quellcodes ermöglicht. Im Rahmen des Projekts qualifiziert QFINITY das Tool ebenfalls. Dadurch wird sichergestellt, dass es den Anforderungen und Standards entspricht.
Der Validation Manager überprüft und validiert die technischen Anpassungen, um sicherzustellen, dass sie den Vorgaben und Prozessen von SAP S/4HANA entsprechen. Umfangreiche Tests werden durchgeführt, um die Funktionsfähigkeit und Stabilität der neuen Version zu gewährleisten.
QFINITY arbeitet eng mit dem Projektteam zusammen, und hilft alle notwendigen technischen Anpassungen und Tests termingerecht abzuschließen. Die Sicherung der Qualität und die effiziente Nutzung des smartShift Tools tragen dazu bei, dass das Upgrade auf SAP S/4HANA erfolgreich verläuft und die gewünschten Vorteile und Verbesserungen erzielt werden.
Durch die Umstellung auf SAP S/4HANA profitiert das Unternehmen von zahlreichen Vorteilen, wie einer verbesserten Datenverwaltung, erhöhter Leistungsfähigkeit und modernen Funktionen, die die Geschäftsprozesse optimieren. Dank des Engagements von QFINITY als Validation Manager und der Nutzung des smartShift Tools ist das Unternehmen bestens gerüstet, um den Wandel zu meistern und die Vorteile von SAP S/4HANA optimal zu nutzen.
Weitere Informationen zu der neuen Version finden Sie hier.
Sie brauchen Hilfe bei einem Wechsel zu der neuen SAP Version? Dann kontaktieren Sie uns gerne über unser Kontaktformular.