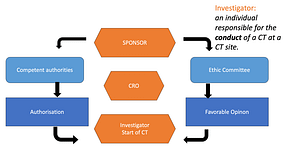
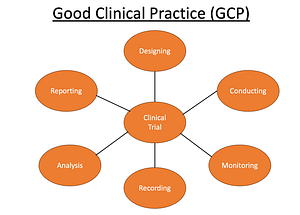
 Ein renommiertes Koordinationszentrum für klinische Studien im universitären Umfeld benötigt, eine tiefgehende Prüfung seiner GCP (Gute Klinische Praxis)-Prozesse. Dafür hat es QFINITY beauftragt. Dieses umfangreiche Audit erstreckt sich über verschiedene Aspekte. Darunter die Überwachung der Einhaltung der GCP-Richtlinien sowie die Bewertung der Effizienz und Wirksamkeit der bestehenden Prozesse.
Ein renommiertes Koordinationszentrum für klinische Studien im universitären Umfeld benötigt, eine tiefgehende Prüfung seiner GCP (Gute Klinische Praxis)-Prozesse. Dafür hat es QFINITY beauftragt. Dieses umfangreiche Audit erstreckt sich über verschiedene Aspekte. Darunter die Überwachung der Einhaltung der GCP-Richtlinien sowie die Bewertung der Effizienz und Wirksamkeit der bestehenden Prozesse.
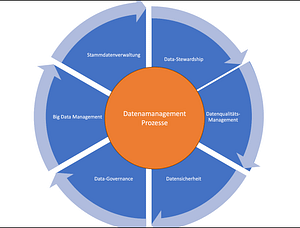
Zusätzlich zur GCP-Bewertung liegt der Schwerpunkt des Audits auf den computergestützten Systemen. Diese Systeme werden im Datenmanagement und in der statistischen Analyse eingesetzt. QFINITY∞ wird eine gründliche Validierung dieser Systeme durchführen, um sicherzustellen, dass sie zuverlässig und fehlerfrei arbeiten. Dies gewährleistet nicht nur die Qualität der Studiendaten, sondern trägt auch zur Integrität und Genauigkeit der Forschungsergebnisse bei.
Die Zusammenarbeit mit QFINITY∞ bietet dem Koordinationszentrum die Möglichkeit, seine Prozesse zu optimieren, sicherzustellen, dass sie den höchsten Qualitätsstandards entsprechen, und gleichzeitig das Vertrauen in die Ergebnisse klinischer Studien zu stärken.
Allgemeine Informationen zu GCP finden Sie hier. Gerne können Sie uns bei Fragen über unser Kontaktformular kontaktieren.